Vaxneuvance® (indikace pro dospělé)
Vaxneuvance® je 15valentní pneumokoková konjugovaná vakcína, nyní dostupná pro Vaše pacienty.

Vakcína Vaxneuvance® vyvolala noninferiorní imunitní odpovědi vs. PCV13 (pneumokoková konjugovaná vakcína, 13valentní) pro 13 sdílených sérotypů a superiorní imunitní odpovědi pro sdílený sérotyp 3 a pro jedinečné sérotypy 22F a 33F.1
Vaxneuvance® obsahuje sérotypy, které patří mezi nejfrekventovanější sérotypy způsobující invazivní pneumokoková onemocnění (IPO) u dospělých ve věku ≥ 65 let v Evropě, včetně sérotypů 3 a 22F.1,2
Výsledky fáze 3 klinického hodnocení vs. PCV13 u dospělých ve věku ≥ 50 let ukazují, jak vakcína Vaxneuvance® pomáhá chránit pacienty před pneumokokovým onemocněním pomocí:1
- robustní imunitní odpovědi proti všem sérotypům sdíleným s PCV13
- superiorní imunogenity pro sérotypy 3, 22F a 33F
HODNOCENÉ POPULACE
Vakcína Vaxneuvance® byla hodnocena v širokém spektru dospělé populace včetně jedinců, u nichž je zvýšené riziko IPO a pneumokokové pneumonie.1
Někteří dospělí mají vyšší riziko rozvoje IPO a pneumokokové pneumonie v porovnání se zdravými dospělými stejného věku. Vakcína Vaxneuvance® byla hodnocena v robustním programu klinického hodnocení u několika ohrožených populací včetně imunokompetentních dospělých s určitým chronickými onemocněními, dospělých s behaviorálními rizikovými faktory, imunokompromitovaných dospělých s HIV a dospělých ve věku ≥ 65 let.1
TERAPEUTICKÁ INDIKACE PRO DOSPĚLÉ
Vakcína Vaxneuvance® je indikována k aktivní imunizaci za účelem prevence invazivního onemocnění a pneumonie způsobené bakterií Streptococcus pneumoniae u jedinců ve věku 18 let a starších.1
NONINFERIORITA
V pivotní fázi 3 klinického hodnocení u dospělých ve věku ≥ 50 let vyvolala vakcína Vaxneuvance® pro sdílené sérotypy s PCV13 noninferiorní imunitní odpovědi. Imunitní odpovědi po očkování proti pneumokokům lze stanovit měřením odpovědí v podobě opsonofagocytární aktivity (OPA). OPA představuje schopnost funkčních protilátek opsonizovat pneumokokové kapsulární polysacharidy a pak je prezentovat fagocytujícím buňkám s cílem je pohltit a následně usmrtit. Jsou považovány za důležitý imunologický zástupný parametr při měření ochrany proti pneumokokovému onemocnění u dospělých.1
Design studie: V pivotní, dvojitě zaslepené, aktivním komparátorem kontrolované studii bylo 1 205 pneumokokovou vakcínou dosud nevakcinovaných dospělých ve věku 50 let a starších randomizováno do skupiny ošetřené vakcínou Vaxneuvance® nebo skupiny ošetřené PCV13. Imunogenita byla hodnocena pomocí OPA a odpovědí IgG pro konkrétní sérotyp 30 dní po vakcinaci. Studie byla navržena pro prokázání noninferiority GMT OPA v porovnání s PCV13 pro 13 sdílených sérotypů (sérotypů, které obsahuje jak vakcína Vaxneuvance®, tak PCV13) a superiority pro 2 sérotypy jedinečné pro vakcínu Vaxneuvance® (22F a 33F) a pro sdílený sérotyp 3. Hodnocení noninferiority bylo založeno na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 0,5.*
*Závěr noninferiority pro 13 sdílených sérotypů je založen na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 0,5. Závěr superiority pro sérotyp 3 je založen na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 1,2. Závěr superiority pro 2 jedinečné sérotypy je založen na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 2,0.
CI = interval spolehlivosti; GMC = geometrické průměrné koncentrace; GMT = geometrické průměrné hodnoty titrů; IgG = imunoglobulin G;
OPA = opsonofagocytární aktivita; PCV13 = 13valentní pneumokoková konjugovaná vakcína
SÉROTYP 3, 22F A 33F
Vakcína Vaxneuvance® vyvolala o ~60 % vyšší imunogenitu vs. PCV13 proti sérotypu 3, jenž je přední příčinou invazivního pneumokokového onemocnění u dospělých v Evropě.1,2
Porovnání opsonofagocytární aktivity (OPA) pro daný sérotyp, geometrické průměrné hodnoty titrů (GMT)

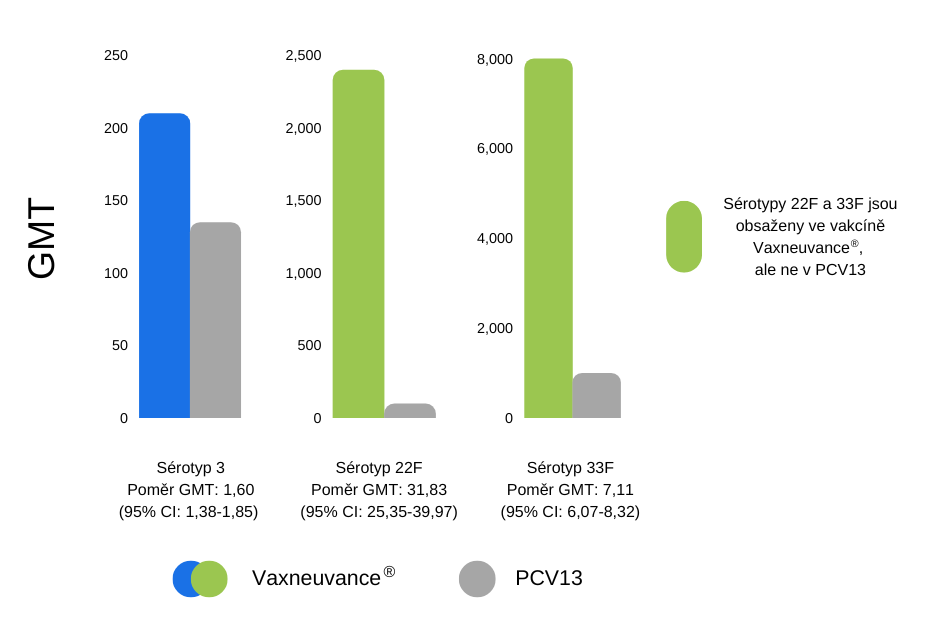
Design studie (pokračování): Hodnocení superiority bylo založeno na meziskupinovém srovnání geometrických průměrných hodnot OPA a podílů účastníků s ≥ 4násobným zvýšením sérotypově specifických titrů OPA mezi obdobím před vakcinací a 30. dnem po vakcinaci. Pro sérotyp 3 byl závěr superiority založen na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 1,2. Pro sérotypy 22F a 33F byl závěr superiority založen na spodní hranici 95% CI odhadovaného poměru GMT (Vaxneuvance®/PCV13) > 2,0.1
SPECIÁLNÍ POPULACE
VAKCÍNA VAXNEUVANCE® BYLA HODNOCENA U RŮZNÝCH OHROŽENÝCH POPULACÍ

Vakcína Vaxneuvance® byla hodnocena v širokém spektru dospělé populace včetně jedinců, u nichž je zvýšené riziko pneumokokového onemocnění.1 Bezpečnost a imunogenita vakcíny Vaxneuvance® byla hodnocena v sedmi randomizovaných, dvojitě zaslepených klinických studií u dospělých ve věku ≥ 18 let, které byly prováděny v Severní a Jižní Americe, Evropě a v Asijsko-pacifickém regionu.1
Ve dvou z těchto hodnocení byly hodnoceny populace se zvýšeným rizikem:
Dospělí ve věku ≥ 18 s HIV, imunokompromitujícím onemocněním
Design studie: Ve dvojitě zaslepené, deskriptivní studii byla bezpečnost a imunogenita Vaxneuvance® hodnocena u pneumokokovou vakcínou dosud nevakcinovaných subjektů s HIV s počty T-lymfocytů CD4+ ≥ 50 buněk na mikrolitr a plasmatickou ribonukleovou kyselinou (RNA) HIV < 50 000 kopií/ml. Přibližně 300 dospělých bylo randomizováno do skupiny vakcinované vakcínou Vaxneuvance® nebo do skupiny vakcinované PCV13, o 2 měsíce později následovala vakcína PNEUMOVAX®23 (PPV23, pneumokoková vakcína, polysacharidová, MSD).1
Výsledky: Vaxneuvance® prokázala imunitní odpovědi pro všech 15 sérotypů obsažených ve vakcíně. Dále byly imunitní odpovědi po sekvenčním podání vakcíny PNEUMOVAX®23 pro těchto 15 sérotypů mezi jedinci, kteří nejprve obdrželi vakcínu Vaxneuvance® nebo PCV13, obecně srovnatelné.* Bezpečnostní profil vakcíny Vaxneuvance® u jedinců s HIV byl obecně konzistentní s bezpečnostním profilem u imunokompetentních jedinců, kteří nikdy nebyli očkovaní proti pneumokokům.1
Dospělí ve věku 18–49 let s chronickým onemocněním a behaviorálními rizikovými faktory pneumokokového onemocnění
Design studie: V dvojitě zaslepené popisné studii bylo 1 515 imunokompetentních dospělých ve věku 18 až 49 let s rizikovými faktory pneumokokového onemocnění nebo bez nich randomizováno v poměru 3:1 a dostali vakcínu Vaxneuvance® nebo PCV13, s následnou aplikací vakcíny PNEUMOVAX®23 o šest měsíců později. Do studie byli zahrnuti jedinci s jedním nebo více následujícími rizikovými faktory pneumokokového onemocnění: diabetes mellitus, poruchy funkce ledvin, chronické onemocnění srdce, chronické onemocnění jater, chronické onemocnění plic včetně astmatu nebo behaviorální rizikové faktory (např. kouření, vyšší příjem alkoholu). Z jedinců, kteří obdrželi Vaxneuvance®, mělo 54,7 % (n = 620) 1 rizikový faktor a 20,1 % (n = 228) mělo 2 či více rizikových faktorů.1
Výsledky: V obou těchto podskupinách rizikových faktorů prokázala vakcína Vaxneuvance® imunitní odpovědi na všech 15 sérotypů obsažených ve vakcíně. Tyto odpovědi byly obecně konzistentní s odpověďmi pozorovanými u celkové hodnocené populace. Sekvenční podání Vaxneuvance® následované podáním vakcíny PNEUMOVAX®23 také vyvolalo imunitní odpovědi pro všech 15 sérotypů.* Bezpečnostní profil vakcíny Vaxneuvance® byl v obou podskupinách rizikových faktorů obecně konzistentní s bezpečnostním profilem u celkové hodnocené populace.1
*V obou těchto hodnoceních byla imunogenita pro všech 15 sérotypů obsažených ve Vaxneuvance® hodnocena pomocí geometrických průměrným hodnot titrů (GMT) opsonofagocytární aktivity (OPA) a geometrických průměrných hodnot koncentrací (GCM) imunoglobulinu G (IgG) 30 dní po vakcinaci.
NEJČASTĚJI HLÁŠENÉ NEŽÁDOUCÍ ÚČINKY
BEZPEČNOST VAKCÍNY VAXNEUVANCE® BYLA HODNOCENA V KLINICKÝCH STUDIÍCH U > 7 000 PACIENTŮ. Do 7 klinických studií byli zařazeni dospělí, kteří byli zdraví a imunokompetentní (N = 7 136) a dospělí s HIV (N = 302).1

POUŽITÍ S OSTATNÍMI VAKCÍNAMI
Vakcína Vaxneuvance® byla hodnocena za různých klinických podmínek.1
Vaxneuvance® je možné podávat:1
- současně s inaktivovanou vakcínou proti chřipce
- jako součást sekvenčního režimu s následným podáním vakcíny PNEUMOVAX®23 (pneumokoková polysacharidová vakcína)†
- po předchozím očkování přípravkem PNEUMOVAX®23‡
†Ve dvojitě zaslepené, aktivním komparátorem kontrolované studii bylo 652 pneumokokovou vakcínou dosud nevakcinovaných subjektů ve věku ≥ 50 let randomizováno do skupiny, jíž se podala vakcína Vaxneuvance®, nebo do skupiny, jíž se podala 13valentní pneumokoková polysacharidová konjugovaná vakcína a následně o rok později PPV23. Po vakcinaci PPV23 byly geometrické průměrné hodnoty titrů OPA a geometrické průměrné hodnoty koncentrací IgG mezi těmito dvěma vakcinačními skupinami pro všech 15 sérotypů přítomných ve vakcíně Vaxneuvance® srovnatelné.1
Ve dvojitě zaslepené popisné studii bylo 1 515 imunokompetentních subjektů ve věku 18 až 49 let s rizikovými faktory pneumokokového onemocnění nebo bez nich randomizováno v poměru 3:1 a dostali vakcínu Vaxneuvance® nebo 13valentní pneumokokovou polysacharidovou konjugovanou vakcínu, následně o 6 měsíců později PPV23. Vakcína Vaxneuvance® vykázala imunitní odpovědi u všech 15 sérotypů hodnocených pomocí GMT OPA a GMC IgG. Po vakcinaci PPV23 byly geometrické průměrné hodnoty titrů OPA a geometrické průměrné hodnoty koncentrací IgG mezi těmito dvěma vakcinačními skupinami pro všech 15 sérotypů obecně srovnatelné.1
Ve dvojitě zaslepené, deskriptivní studii byla bezpečnost a imunogenita vakcíny Vaxneuvance® hodnocena na dospělých ve věku ≥ 18 let s HIV, kteří nikdy nebyli očkovaní proti pneumokokům, jejichž hodnoty CD4+ T-buněk byly ≥ 50 buněk na mikrolitr a hodnota plazmatické HIV RNA < 50 000 kopií/ml. V této studii bylo 302 subjetků randomizováno k obdržení buď vakcíny Vaxneuvance®, nebo PCV13, následováno PNEUMOVAX®23 o dva měsíce později. Vakcína Vaxneuvance® byla dle hodnocení pomocí GMT OPA a GMC IgG imunogenní 30 dní po vakcinaci pro všech 15 sérotypů obsažených ve vakcíně Vaxneuvance®. Po následném podání vakcíny PNEUMOVAX®23 byly GMT OPA a GMC IgG obecně srovnatelné 30 dní po vakcinaci mezi oběma skupinami pro všech 15 sérotypů.1
‡Ve dvojitě zaslepené, deskriptivní studii bylo 253 subjektů ve věku ≥ 65 let, kteří byli předtím vakcinováni PPV23 nejméně jeden rok před vstupem do studie, randomizováno do skupiny očkované vakcínou Vaxneuvance® nebo do skupiny vakcinované 13valentní pneumokokovou polysacharidovou konjugovanou vakcínou. Geometrické průměrné hodnoty koncentrací IgG a geometrické průměrné hodnoty titrů OPA byly mezi těmito dvěma vakcinačními skupinami pro 13 společných sérotypů srovnatelné a pro 2 jedinečné sérotypy vyšší ve skupině vakcinované vakcínou Vaxneuvance®.1
REFERENCE
- SPC Vaxneuvance®
- European Centre for Disease Prevention and Control. Invasive pneumococcal disease. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC. 2020.