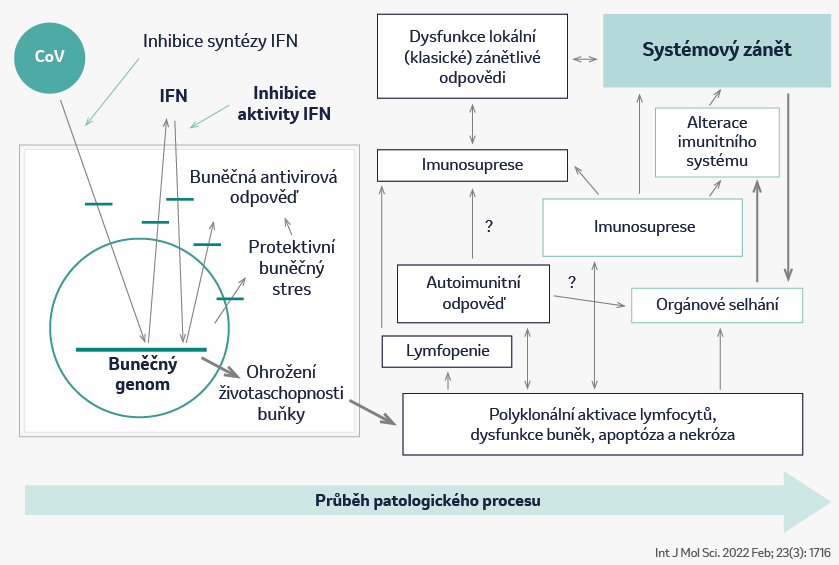
Patogeneze
Patogeneze onemocnění COVID-19
- Virus SARS-Cov-2 vstupuje za využití receptoru ACE2 do pneumocytů typu II a následně v nich inhibuje syntézu IFN (protivirové cytokiny).
- Replikace viru v buňkách vede k aktivaci prozánětlivých cytokinů a lymfocytů, které se hromadí v ohnisku infekce, což vede k rozvoji lymfopenie.
- Lymfopenie může vyústit v imunosupresi.
- Aktivace prozánětlivých cytokinů vede k dysfunkci a selhání orgánů.
- Stimulace imunitního systému způsobená infekcí vede také k aktivaci autoimunitních procesů.
Mechanismus aktivace imunitního systému a alveolární koagulopatie asociovaná s onemocněním COVID-19
- Ke koagulopatii asociované s onemocněním COVID-19 může přispívat řada procesů, včetně přímé infekce pneumocytů typu II a endoteliálních buněk, a má za následek poškození alveolárně-kapilární bariéry a zvýšení propustnosti cév.
- Zánětlivé reakce charakterizované aktivací T-lymfocytů, neutrofilů, monocytů, makrofágů a krevních destiček vedou k uvolňování velkého množství zánětlivých cytokinů (včetně IL-1, IL-6, IL-10, TNF-α).
- Výše uvedené stavy mají za následek vznik trombů tvořených fibrinem, NET a trombocyty, a to na mikrovaskulární i makrovaskulární úrovni.
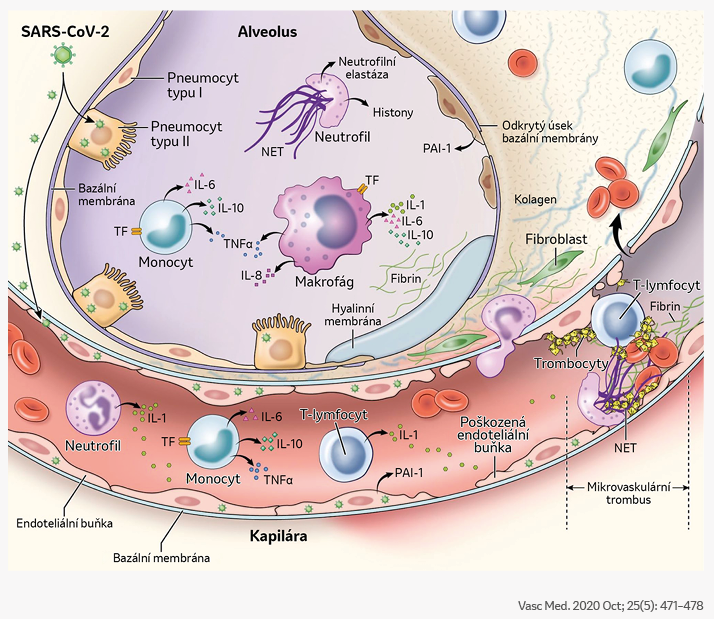
IL, interleukin; NET, neutrofilní extracelulární past; PAI-1, inhibitor aktivátoru plazminogenu 1; TF, tkáňový faktor; TNF-α, tumor nekrotizující faktor alfa.
Modulace prozánětlivé odpovědi hostitele a dráhy programované buněčné smrti
Řada proteinů viru SARS-CoV se podílí na modulaci syntézy prozánětlivých faktorů, což pravděpodobně přispívá k rozvoji tzv. cytokinové bouře.
J Biol Chem 2020 Sep 11;295(37):12910-12934.
Dysregulace imunitní odpovědi

- Pacienti s onemocněním COVID-19 vykazují zvláštní vzory imunitní dysregulace, zejména se jedná o zvýšení hladin IL-6, což koreluje se závažným průběhem onemocnění a rizikem úmrtí.
- Vysoké hladiny IL-6 hrají významnou roli v patogenezi akutního poškození plic.
- Blokování aktivity IL-6 vede ke zmírnění příznaků respiračního selhání.
J Biol Chem 2020 Sep 11;295(37):12910-12934.
Mechanismus tvorby cévních trombů ve spojení s onemocněním COVID-19
- Koronavirus napadá nejen hostitelské buňky plicního epitelu, ale může napadat i endoteliální buňky.
- Infekce vede ke vzniku molekulárních vzorů asociovaných s poškozením (DAMP), které mohou iniciovat aktivaci vrozené imunitní odpovědi a udržovat neinfekční zánětlivou reakci.
- Infekce také aktivuje uvolňování prozánětlivých cytokinů a chemokinů.
- Dále dochází k zapojení a aktivaci leukocytů a trombocytů, což iniciuje intravaskulární produkci trombinu, další aktivaci endotelu, trombocytů a leukocytů v nepřetržité zpětnovazební smyčce, která udržuje produkci trombinu a rozvoj trombózy. V této kaskádě má aktivace komplementu také protrombotickou roli, neboť vede k zapojení leukocytů a zvýšení aktivace trombocytů, což prohlubuje endoteliální dysfunkci a prozánětlivý stav.
- Hypoxie výše uvedené procesy dále posiluje. Aktivace koagulační kaskády nakonec vede ke klinickým projevům virové koagulopatie, mezi něž patří hluboká žilní trombóza, plicní embolie, arteriální trombóza, mikrovaskulární trombóza a ischemická cévní mozková příhoda.
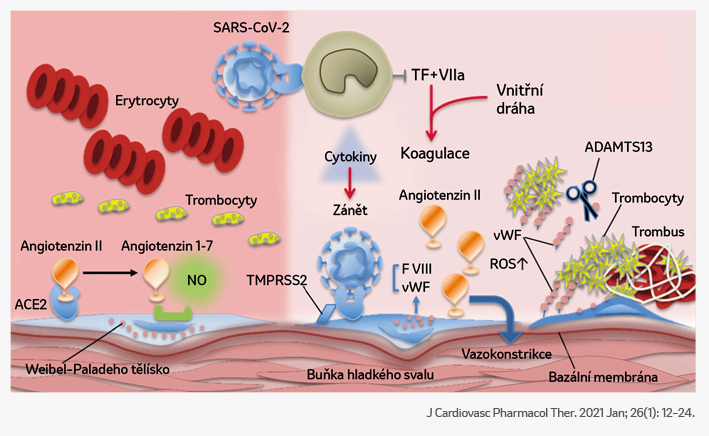
NET = neutrofilní extracelulární past; PolyP = polyfosfát; TF = tkáňový faktor; vWF = von Willebrandův faktor.
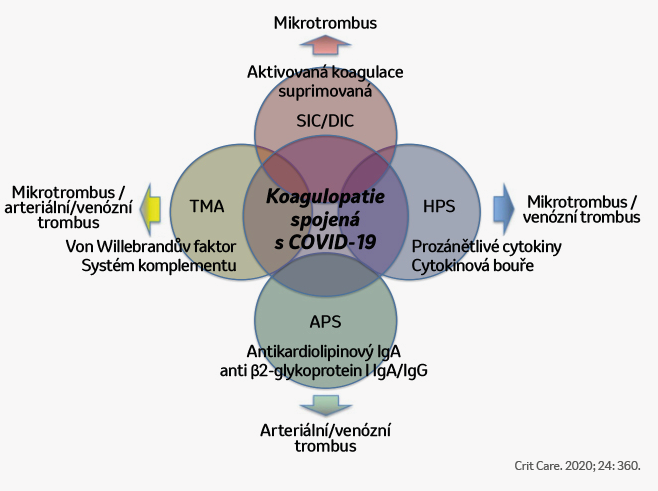
Protrombotický mechanismus spojený s onemocněním COVID-19 zahrnuje faktory, které jsou známé i u jiných poruch koagulace (DIC, TMA, HPS, APS)
Projevy koagulopatie spojené s onemocněním COVID-19. Klinické a laboratorní projevy koagulopatie spojené s onemocněním COVID-19 (CAC, ang. COVID-19-associated coagulopathy) se částečně shodují s koagulopatií vyvolanou sepsí (SIC, ang. sepsis-induced coagulopathy)/diseminovanou intravaskulární koagulací (DIC, ang. disseminated intravascular coagulation), hemofagocytárním syndromem (HPS, ang. hemophagocytic syndrome)/hemofagocytární lymfohistiocytózou (HLH, ang. hemophagocytic lymphohistiocytosis), antifosfolipidovým syndromem (APS, ang. antiphospholipid syndrome) a trombotickou mikroangiopatií (TMA, ang. thrombotic microangiopathy); nezapadají však přesně do žádné z uvedených koagulopatií.
Imunitní paměť

- Vzhledem k odlišnosti S proteinu se jen malý počet dříve identifikovaných monoklonálních protilátek proti virům SARS-CoV váže na virus SARS-CoV-2 a neutralizuje ho.
- Ochranné titry neutralizačních protilátek a imunitní odpověď paměťových B-lymfocytů jsou proto u pacientů po vyléčení infekce relativně krátkodobé.
- Paměťová imunitní odpověď zajišťovaná T-lymfocyty může na rozdíl od odpovědi B-lymfocytů přetrvávat u velké podskupiny pacientů po infekci virem SARS až 6 let, samotné paměťové T-lymfocyty nejsou však pravděpodobně schopné zajistit dostatečnou dlouhodobou imunitní ochranu.
Int J Mol Sci. 2022 Feb; 23(3): 171